Jei norite tapti asociacijos „Kraujas“ nariu, užpildykite žemiau esančią formą. Tapdami bendrijos „Kraujas“ nariu, Jūs gausite pranešimus apie bendrijos veiklas, naujienas ir renginius.

Lėtinė mieloleukemija (LML) yra viena iš keturių pagrindinių leukemijos tipų. LML prasideda nuo kamieninių ląstelių pokyčių. Kiekvienoje ląstelėje yra branduolys, kuriame yra chromosomos su genais. Genuose užkoduotos „instrukcijos“ ląstelių veiklai. Normaliose ląstelėse yra 23 chromosomų poros (22 autosomų poros ir viena pora chromosomų, apsprendžianti žmogaus lytį). LML sergančių pacientų organizmuose nustatoma vadinamoji Filadelfijos chromosoma, kuri susidaro tuomet, kai atskyla tam tikra 22-osios chromosomos dalis.
Sergantiesiems LML susikeičia 9 – osios ir 22 – osios chromosomų dalys, tai vadinama genų translokacija. Dalis 9 – ojoje chromosomoje esančio ABL geno suskyla, o atskilusioje 22 – osios chromosomos dalyje yra BCR genas. Šios dvi atskilusios dalys susikeičia vietomis ir 9 – osios chromosomos dalis prisijungia prie 22 – osios chromosomos galo. Tokiu būdu susidaro vėžį sukeliantis BCR – ABL genas. Šio geno gaminamas baltymas skatina vystytis LML. Taigi pakitęs BCR – ABL genas gamina pakitusį BCR – ABL vadinamą baltymą, kuris skatina gamintis pakitusias baltąsias kraujo ląsteles:
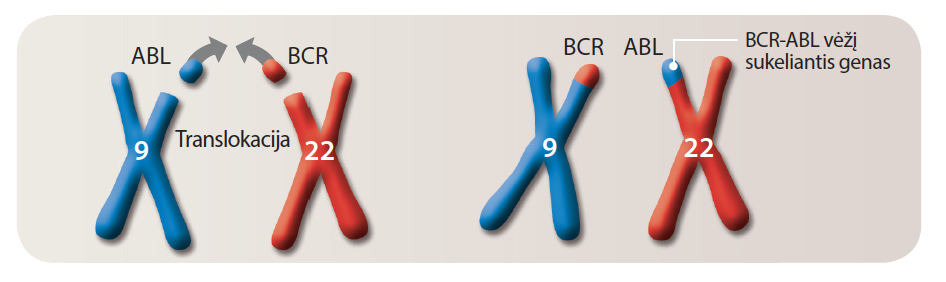
BCR–ABL geno susidarymas
Sveiko žmogaus organizme kraujo ląstelių dalijimasis yra kontroliuojamas. Sergant lėtine mieloleukemija (LML) ši funkcija sutrinka. Filadelfijos chromosomoje esantis BCR – ABL genas koduoja baltymą tirozinkinazę, kuris kontroliuoja kamieninių ląstelių virtimą baltaisiais kraujo kūneliais (granuliocitais ar blastais).
Sergant LML, kaulų čiulpuose gaminasi per daug kamieninių kraujo ląstelių, kurios diferencijuojasi į baltuosius kraujo kūnelius (granuliocitus). Dalis šių kamieninių kraujo ląstelių niekada netampa brandžiais baltaisiais kūneliais. Tokios ląstelės vadinamos blastais. BCR – ABL genas taip pat sąlygoja nepertraukiamą leukocitų gamybą kaulų čiulpuose. Reguliariai didėjant nebrandžių leukocitų (blastų) kiekiui, jie patenka į kraują, išplinta po visą organizmą ir kaupiasi įvairiuose organuose, daugiausia kepenyse ir blužnyje. Palaipsniui ligos eiga tampa agresyvesnė, kaulų čiulpuose gaminasi vis didesnis kiekis nebrandžių granuliocitų – blastų, kurie kaupdamiesi kaulų čiulpuose, slopina normalių kraujo ląstelių (granuliocitų, trombocitų, eritrocitų) gamybą.
Lėtinė mieloleukemija (LML) yra lėtai progresuojanti kraujo ir kaulų čiulpų liga, kuri paprastai pasireiškia vyresniame amžiuje ir labai retai pasireiškia vaikams. Priežastys, dėl kurių susergama LML, nėra visiškai aiškios:
Visiškai aišku, kad šia liga negalima užsikrėsti nuo ja sergančio žmogaus. Taip pat žinoma, kad tai nėra paveldimas susirgimas, perduodamas iš kartos į kartą. Šiuo metu yra vis dar atliekami tyrimai, siekiant suprasti visus pokyčius, kurie lemia Filadelfijos (Ph+) chromosomos ir vėžį sukeliančio BCR–ABL geno susidarymą.
LML dažniausiai pasireiškia nuovargiu, naktiniu prakaitavimu ir karščiavimu. Šiuos ir panašius simptomus gali sukelti ir kitos ligos. Labai svarbu pasakyti savo gydytojui, jei jaučiate:
Kartais LML nesukelia visiškai jokių simptomų. Ši liga ypač klastinga ir tyli. Pradinės ligos stadijos dažnai diagnozuojamos atsitiktinai atlikus kraujo tyrimą, kaulų tyrimą dėl kokių nors kitų priežasčių. Tokie nespecifiniai ligos simptomai kaip silpnumas, pykinimas atsiranda jau praėjus kuriam laikui nuo ligos pradžios. Dauguma pacientų skundžiasi pablogėjusia bendra sveikata, silpnumu, fizinio krūvio netoleravimu, energijos stoka. Taip pat vargina simptomai, susiję su kepenų ir blužnies padidėjimu.
Lėtinės mieloleukemijos (LML) eiga yra išskiriama į 3 stadijas: lėtinę, akceleracijos ir blastinę. Apie 85 proc. LML atvejų diagnozuojama lėtinėje fazėje. Jaunų žmonių LML yra agresyvesnė, ji dažnai diagnozuojama akceleracijos ar blastinės krizės fazėje. Kartais ligoniai kreipiasi dėl LML jau blastinės ar akceleracijos fazėse, nes prasideda kraujavimai, infekcijų komplikacijos, kaulų skausmai, karščiavimas.
Akceleracijos ir blastinės krizės stadijose taikomas žymiai intensyvesnis gydymas, kurio tikslas sugrąžinti ligą į lėtinę fazę ir sumažinti pacientą varginančius simptomus.
Jos metu proliferuoja subrendusios granuliocitinės ląstelės. Lėtinėje LML stadijoje ne daugiau 10 proc. kraujo ir kaulų čiulpų ląstelių sudaro blastai (neišsivysčiusios kaulų čiulpų ląstelės). Dauguma LML atvejų (>90 proc.) diagnozuojama šioje ligos stadijoje. Paprastai dauguma žmonių jaučiasi gerai arba ligos simptomai nesukelia nusiskundimų. Tiriant pacientą aptinkama padidėjusi blužnis, padidėjęs leukocitų skaičius, tačiau pradėjus gydymą šie pokyčiai greitai grįžta į normalią būseną.
Lėtinės stadijos metu:
Anksčiau, iki tirozinkinazės inhibitorių (imatinibo, nilotinibo, dasatinibo) atradimo, lėtinė fazė trukdavo nuo 3 iki 5 metų. Taikant šiuolaikinį gydymą tirozinkinazės inhibitoriais lėtinė fazė gali tęstis 15 ir daugiau metų.
Kai kuriais atvejais, nepaisant taikomo gydymo, po tam tikro laiko liga gali pradėti progresuoti – prasideda taip vadinama akceleracijos stadija. Tuomet stebimas vis didesnis kraujo ląstelių kiekio nuokrypis nuo normos ribų, daugėja nebrandžių ląstelių kiekis. Akceleracijos stadijoje nuo 10 iki 20 proc. kraujyje ir kaulų čiulpuose esančių ląstelių sudaro blastai, randami ir kiti citogenetiniai, ne tik Filadelfijos chromosomos, pokyčiai. Akceleracijos fazės metu pacientams gali pasireikšti anemija.
Akceleracijos stadijos metu:
Blastinės stadijos arba blastinės krizės stadijoje liga tampa panaši į ūminę leukemiją. Šiai stadijai būdinga tai, kad daugiau nei 20 proc. kraujyje ir kaulų čiulpuose esančių ląstelių sudaro blastai, pacientą pradeda varginti pastovus karščiavimas, gausus prakaitavimas, ryškus svorio kritimas bei kaulų skausmai. Dėl normalios kraujodaros sutrikimo ir normalių kraujo ląstelių kiekio sumažėjimo atsiranda sunki mažakraujystė, kraujavimai, vargina infekcijos. Greitai besidauginančios blastinės ląstelės gali kauptis blužnyje, limfiniuose mazguose, kepenyse, odoje ir smegenyse. Apie beprasidedančią blastinę krizę gali signalizuoti padidėjusi blužnis. Būna atvejų, kad blužnis čiuopiama daugiau nei 5 cm žemiau kairiojo šonkaulių lanko. Kuo didesnė blužnis, tuo didesnis leukocitų skaičius kraujyje. Bet kokiu atveju, pravartu žinoti, kad blastinė krizė pacientams pasireiškia retai.
Norint diagnozuoti LML, atliekami trys svarbiausi sudėtingi veninio kraujo ir kaulų čiulpų tyrimai, naudojami ne tik ligos diagnozei, bet gydymo efektyvumui įvertinti bei padedantys gydymo tikslams pasiekti. Kuo geriau suprasite Jums atliekamų tyrimų reikšmę, tuo lengviau ir sąmoningiau priimsite svarbius su Jūsų sveikata susijusius sprendimus. Trys pagrindiniai tyrimai, kuriuos gydytojas hematologas turi atlikti, kad galėtų įvertinti
Jūsų atsaką į gydymą yra šie:
Kiti atliekami tyrimai, sergant LML:
Citogenetinio tyrimo metu paimta medžiaga tiriama žiūrint pro mikroskopą, įvertinamas ligos išplitimas bei kaulų čiulpų funkcija. Kaulų čiulpų aspiracija ir biopsija atliekami visuomet prieš pradedant gydymą ir tęsiami kas 3-6 mėnesius kol bus pasiekiamas visiškas citogenetinis atsakas. Paprastai abu tyrimai atliekami vienu metu. Citogenetinio tyrimo metu kaulų čiulpų mėginio ląstelės yra stebimos pro mikroskopą. Ieškoma tam tikrų chromosomų pokyčių 9 ir 22 chromosomų poroje, vadinamosiose Filadelfijos chromosomose (Ph+).
Kadangi mokslas ir diagnostikos technologijos sparčiai žengia į priekį, RQ–PCR tyrimas šiandien yra geriausias būdas, norint tiksliai įvertinti ligos eigą ir stebėti ligą sukeliančio BCR–ABL kiekio kraujyje pokyčius, ypač jei ligos aktyvumas organizme yra mažas.
Liktinė liga arba BCR–ABL liktinis kiekis, gali sukelti Ph+ LML atsinaujinimą. Pasaulio sveikatos organizacija (PSO) oficialiai pripažįsta, kad BCR–ABL geno mutacija Filadelfijos chromosomoje (PH+) yra lėtinės mieloleukemijos priežastis.
Ką reikėtų žinoti apie ligos diagnostiką?
Šiuolaikinės medicinos ir technologijų pažangos dėka šiuo metu LML pacientams prieinama daugybė gydymo metodų. Parenkant tinkamą LML gydymą paprastai atsižvelgiama į ligos stadiją, paciento amžių ir bendrą būklę. LML gydyti gali būti taikoma biologinė terapija, chemoterapija, transplantacija, donoro limfocitų infuzija (DLI), leukaferezė.
Gydant LML tirozinkinazės inhibitorių (TKI) grupės vaistais pakanka kasdien gerti vaistus ir kas kelis mėnesius apsilankyti pas gydytoją kontroliniams tyrimams. Šiuolaikinio gydymo dėka LML sergantis žmogus išlieka darbingas ir gali gyventi visavertį gyvenimą. Gydymas šiais medikamentais yra neabejotinai efektyviausias, taikomas visose išsivysčiusiose šalyse. Šiandien Lietuvoje sergantys LML gauna gydymą ir gyvena pilnavertį gyvenimą. Tai yra siekiamybė ir kokybiško LML gydymo tikslas. Svarbiausia, kad pacientas efektyvų gydymą gautų iš karto, vos diagnozavus ligą.
Ligos priežasties ir vystymosi mechanizmų supratimas paskatino plėtoti genetiškai orientuotus vaistus nuo vėžio, kurie padarė perversmą onkologinių ligų gydymo istorijoje. Naujausias ir moderniausias LML gydymo metodas yra tirozinkinazės inhibitoriai (TKI): imatinibas, nilotinibas, dasatinibas, bosutinibas, ponatinibas, kurie efektyviai slopina BCR–ABL geną, atsiradusį dėl Filadelfijos chromosomos anomalijos. Tokiu būdu slopinama ligos priežastis, o kartu sustabdomas ir BCR vėžinių ląstelių dauginimasis. TKI grupės vaistai dar vadinami taikinių terapija, kadangi jais paveikiamas vėžinėje ląstelėje (BCR-ABL gene) esantis taikinys, kurį užblokavus, vėžinės ląstelės toliau nesigamina. Be to, taikinio gydymo grupės vaistai nenaikina sveikųjų ląstelių, todėl žmogaus imunitetas nėra suardomas.
Tirozinkinazės inhibitorių (TKI) atradimas atvėrė plačias gydymo galimybes didžiajai LML pacientų daliai. Medikai vienareikšmiškai sutaria, kad TKI grupės vaistai šiuo metu yra pažangiausias ir sėkmingiausias LML gydymo būdas.
Šiuo metu pacientai yra gydomi TKI grupės vaistais: imanitibu, nilotinibu, dasatinibu, bosutinibu, ponatinibu. Visi šie vaistai slopina ligos sukėlėją – BCR–ABL geną, atsiradusį dėl Filadelfijos chromosomos mutacijos.
Tirozinkinazės inhibitorių dėka šiandien jau įmanoma blokuoti tirozinkinazės procesą, t. y.:
TKI grupės vaistai blokuoja pakitusio BCR–ABL baltymo perduodamą signalą ir tokiu būdu:
Imatinibas yra registruotas kaip I eilės gydymas. Dažniausiai šis vaistas pacientams yra paskiriamas iš karto, diagnozavus lėtinę LML stadiją. Imatinibas padeda pasiekti staigų visišką hematologinį atsaką (kraujo kūnelių skaičiaus sunormalėjimą) beveik visiems pacientams, sergantiems lėtinės stadijos liga su Filadelfijos chromosoma.
Imatinibas naudojamas kasdien tabletėmis ar kapsulėmis, valgant ar iškart po valgio, užgeriant stikline vandens. Įprastinė vaisto dozė yra 400 mg per dieną, tačiau vaisto dozė individualiu atveju gali būti didinama iki 600 ar 800 mg per dieną. Dauguma pacientų šį vaistą toleruoja neblogai. Šalutiniai reiškiniai paprastai nesunkūs ir labiau pasireiškia gydymo pradžioje. Daugiau nei 80 proc. pacientų pasiekia efektyvią ligos kontrolę (visiškas citogenetinis atsakas), vartodami standartines imatinibo dozes. Gydant vaistiniu preparatu Imatinibum, BCR–ABL geno molekulinis tyrimas atliekamas ne rečiau kaip kas 3 mėnesius, kol BCR–ABL tampa <0,1 proc. ir ne rečiau kaip kas 6 mėnesius, kai BCR–ABL <0,1 proc. Nepaisant greito ir efektyvaus atsako į gydymą imatinibu, maždaug dešimtadaliui pacientų vaistas neveikia ir liga pradeda progresuoti. Atsparumas vaistui beveik visais atvejais atsiranda dėl to, kad atsiranda antrinė BCR–ABL geno mutacija, todėl vaisto molekulė nebeuždengia BCR–ABL geno ir liga progresuoja. Atsparumo išsivystymo rizika yra mažesnė tiems pacientams, kurie imatinibą pradėjo vartoti anksti, praėjus ne daugiau nei keliems mėnesiams po diagnozės. Be to, atsparumo rizika su laiku mažėja. 20–25 proc. pacientų tenka nutraukti imatinibą dėl atsiradusio atsparumo arba dėl sunkių pašalinių reiškinių. Tokiu atveju pacientams gali būti skiriami kiti taikinių terapijos vaistai.
Nilotinibas yra antros kartos TKI, skiriamas I ir II eilės gydymui. Nilotinibas skirtas gydyti suaugusiems pacientams, kuriems yra pirmą kartą diagnozuota lėtinės fazės Filadelfijos chromosomai teigiama lėtinė mieloleukemija (LML), Filadelfijos chromosomai teigiamos LML lėtinė fazė ir akceleracijos fazė, jei pacientas netoleravo ar jam nustatytas atsparumas ankstesnei terapijai (įskaitant imatinibą). Nėra duomenų apie nilotinibo veiksmingumą LML sergantiems ligoniams blastinės krizės atvejais. Nilotinibas vartojamas po 300 mg 2 kartus per parą pacientams, kuriems yra pirmą kartą diagnozuota lėtinės fazės LML, po 400 mg du kartus per parą pacientams, kuriems yra lėtinė fazės ar akceleracijos fazės LML bei kurie netoleravo ar kuriems buvo nustatytas atsparumas ankstesnei terapijai. Gydymą reikia tęsti tol, kol pacientui stebimas teigiamas poveikis. Išryškėjus pašaliniam poveikiui gali prireikti nutraukti / laikinai nutraukti nilotinibo skyrimą ir (arba) mažinti vaisto dozę. Nilotinibą reikia vartoti 2 kartus per parą su maždaug 12 val. pertrauka. Negalima vartoti valgant. 2 val. prieš vaisto vartojimą ir 1 val. po negalima valgyti jokio maisto. Jei pacientas kapsulių nuryti negali, kiekvienos kapsulės turinį galima išmaišyti 1 arbatiniame šaukštelyje obuolių tyrės (trintų obuolių), kurią būtina nedelsiant suvartoti. Negalima naudoti daugiau kaip 1 arbatinio šaukštelio obuolių tyrės ar kitokio maisto nei obuolių tyrė.
Dasatinibas taip pat yra antros kartos TKI, kurio veikimas šiek tiek skiriasi nuo imatinibo ir nilotinibo. Tyrimai parodė, kad dasatinibas gali veikti ir tada, kai pasireiškia atsparumas imatinibui ir nilotinibui dėl BCR–ABL kinazės domeno mutacijų. Dasatinibas dažniausiai vartojamas nepriklausomai nuo valgymo kartą per dieną ir tik esant pažengusiai ligos stadijai gali būti skiriamas du kartus per dieną.
Bosutinibas, ponatinibas – tai tirozinkinazės inhibitoriai, skirti LML gydyti, kai negalimas ar netinkamas gydymas kitais tirozinkinazės inhibotiriais (imatinibu, dasatinibu ar nilotinibu).
Modernus gydymas tirozinkinazės inhibitoriais įrodo, kad vėžinių ląstelių biologiniais tyrimais grįsti gydymo metodai gali pagerinti ligos kontrolę ir sukelti kur kas mažiau šalutinių poveikių. LML tyrimų rezultatai buvo sėkmingi, todėl tapo puikia paskata tirti ir kitas vėžio formas. TKI grupės vaistai iš dalies pakeitė vėžio sąvoką – šiuolaikinės medicinos pažangos dėka, mirtina liga tapo visiškai kontroliuojama lėtine liga, kuri beveik nedaro įtakos pilnaverčiam paciento gyvenimui.
Tai vėžio gydymas vaistais, kurie sustabdo vėžinių ląstelių augimą jas sunaikindami arba slopindami jų dauginimąsi. Vaistai gali būti geriami ar leidžiami į veną ar poodinį sluoksnį. Priklausomai nuo ligonio amžiaus, bendros sveikatos būklės ir ligos eigos gali būti vartojami ir kelių vaistų deriniai. Chemoterapija gali būti skiriama retais atvejais – trumpalaikiam leukocitų skaičiaus mažinimui arba, kai dėl kokių nors priežasčių, negali būti skiriamas gydymas TKI.
Vėlyvesnėse LML stadijose (akceleracijos ar blastinėje) skiriamas intensyvus chemoterapinis gydymas keliais intraveniniais preparatais, sukeliantis daug pašalinių reiškinių ir komplikacijų, pavyzdžiui, pykinimą, vėmimą, burnos išopėjimus, plaukų išslinkimą, viduriavimą, karščiavimą ir kitas sunkias komplikacijas.
Tai gydymas, padedantis paciento imuninei sistemai kovoti su onkologine liga. Šiam gydymui naudojamas vaistas interferonas alfa. Jis gali būti naudojamas ir kartu su imatinibu ar kitais TKI, ypač tais atvejais, kai gydymas vien imatinibu nepakankamai efektyvus. Interferonas skiriamas poodinėmis injekcijomis kasdien arba kelis kartus per savaitę. Deja, interferonas dažnai blogai toleruojamas ir gali sukelti nemažai šalutinių reiškinių, pavyzdžiui, šaltkrėtį, karščiavimą, nuovargį, kaulų skausmus, pykinimą, depresiją.
Didelių dozių chemoterapija kartu su kamieninių kraujo ląstelių transplantacija yra intensyvus ir sunkus gydymas, kurį galima taikyti tik nedidelei daliai LML pacientų. Toks gydymas gali būti siūlomas tik jauniems, paprastai jaunesniems nei 40 metų, pacientams, kuriems medikamentinis gydymas TKI neefektyvus. Šiuo gydymo būdu vėžio pažeistos kraujodaros ląstelės yra pakeičiamos sveikomis donoro kamieninėmis ląstelėmis, sugebančiomis atpažinti ir sunaikinti vėžines ląsteles. Pirmiausia parenkamas tinkamas kamieninių ląstelių donoras, kad vėliau neįvyktų sunkios atmetimo reakcijos. Chemoterapijos pagalba yra sunaikinamos visos paciento kaulų čiulpų ir kraujo ląstelės. Po to į veną lašinamos išskirtos ir specialiai paruoštos donoro kraujo kamieninės ląstelės. Šios prigyja kaulų čiulpuose, pradeda daugintis ir suformuoja naują sveikų kraujo ląstelių būrį. Transplantacijos taikymui būtinos ypatingai sterilios sąlygos, nes sergantysis net keletą savaičių neturi savo leukocitų, todėl būna labai imlus infekcijoms, kurios gali lemti ir paciento mirtį.
Donoro limfocitų infuzija (DLI). Limfocitai (baltųjų kraujo kūnelių rūšis) yra paimami iš donoro kraujo ir suleidžiami pacientui vienos ar keleto infuzijų metu. Donoriniai limfocitai kraujyje sutikę ligonio vėžines ląsteles jas atpažįsta ir sunaikina. Šis gydymas taikomas ligai atsinaujinus po kaulų čiulpų transplantacijos.
Transfuzinė terapija. Leidžia papildyti paciento kraują eritrocitais (raudonaisiais kraujo kūneliais) ir trombocitais, siekiant sumažinti ligos simptomus (mažakraujystę, kraujavimą) ir pagerinti gyvenimo kokybę.
Leukaferezė. Šis gydymo būdas naudojamas vis rečiau ir taikomas tik tada, kai esant kraujyje labai dideliam leukocitų skaičiui pasireiškia organų aprūpinimo krauju sutrikimo požymiai – pasunkintas kvėpavimas, regėjimo sutrikimai, sąmonės pritemimas. Kelias valandas trunkančios ambulatorinės procedūros (leukaferezės) metu, pro specialų ląsteles atrenkantį aparatą praleidžiant iš venos paimtą kraują pašalinamas leukocitų perteklius.
Daugeliui pacientų, vartojančių vaistus LML gydyti, pasireiškia nepageidaujamas gydymo poveikis. Pacientams svarbu sekti savo savijautą ir apie neįprastus pojūčius visuomet pranešti gydytojui hematologui. Pacientai neturi nutraukti vaisto vartojimo savo iniciatyva, neeksperimentuoti keisdami paskirtą vaisto dozę, nes tai neišvengiamai turės įtakos gydymo rezultatams.
Atlikti moksliniai tyrimai parodė, kad TKI pasižymi kardiotoksiškumu – toksiniu poveikiu širdies ir kraujagyslių sistemai. Skirtingi TKI vaistai pasižymi skirtingu poveikio stiprumu ir tai priklauso ne tik nuo vartojamo vaisto, o taip pat ir nuo jo dozės bei gretutinių paciento ligų.
Šios grupės vaistai skirtingais mechanizmais veikia širdies–kraujagyslių sistemą, todėl skiriasi ir sukeliami simptomai:
Gydytojų bendruomenė pripažįsta, kad visi pacientai sergantys LML turėtų būti tiriami ir prižiūrimi dėl galimos kardiovaskulinių ligų rizikos. Dėl šio šalutinio vaistų poveikio reikalingas ypač kruopštus paciento sveikatos ištyrimas bei savistebėsena. Jeigu planuojamas gydymas TKI – idealiu atveju prieš vartojimą reikėtų atlikti išsamų paciento kardiovaskulinių ligų rizikos vertinimą ir pasikonsultuoti su kardiologu, ypač jeigu anksčiau buvo diagnozuota širdies ar kraujagyslių liga, padidintas kraujo spaudimas ar neritmiška širdies veikla. Kiekvieno paciento rizika vertinama individualiai ir esant reikalui gali būti skiriami papildomi tyrimai arba į gydymo komandą įtraukiamas gydytojas kardiologas, siekiant užtikrinti kardiovaskulinių įvykių prevenciją. Tai ypatingai aktualu vartojant ponatinibą dėl jo keliamos kompleksinės rizikos širdies – kraujagyslių sistemai.
Pradėjus gydymą turi būti atidžiai stebima pacientų sveikata, savalaikei nepageidaujamų poveikių diagnostikai. Gydymo metu rekomenduojama atidžiai stebėti savo savijautą, širdies ritmą bei periodiškai matuotis kraujo spaudimą. Pajutus įtartinus simptomus – galvos svaigimą, krūtinės skausmą, širdies permušinėjimus ar panašius, rekomenduojama kreiptis į gydytoją. Gydytojas hematologas gali nuspręsti koreguoti vaistų dozę arba visiškai nutraukti vaistų vartojimą. Svarbu, kad be gydytojo hematologo žinios nepultumėte nutraukti vaistų vartojimo ar mažinti dozės, nes tai gali pabloginti bendrą gydymo efektyvumą.
Kardiovaskulinių įvykių prevencijai rekomenduojama ACDEFKR savikontrolės sistema, kuri, tikėtina, gali sumažinti LML pacientų riziką nepageidaujamiems širdies – kraujagyslių įvykiams.
TKI vaistų grupės atstovai veikia skirtingais mechanizmais ir gali sukelti skirtingus poveikius širdžiai bei kraujagyslėms. Dėl šios priežasties paciento sveikatos priežiūra ir tyrimai gydymo metu gali skirtis, priklausomai nuo bendros paciento rizikos ir vartojamų vaistų. Pateikiame orientacinę schemą, kurioje nurodyti rekomenduojami tyrimai atliekami prieš paskiriant gydymą ar gydymo metu vartojant vieną ar kitą vaistą.
Rekomenduojamų tyrimų schema
Kiekvieno apsilankymo pas šeimos gydytoją metu rekomenduojama aptarti vartojamus vaistus bei naujus simptomus ir nusiskundimus. Yra įrodyta, kad didesnė kardiovaskulinių įvykių rizika yra pacientams, kurie gydosi TKI. Jei šeimos gydytojas nustatė, kad Jums pasireiškė širdies – kraujagyslių sistemos pakenkimo požymių, Jūs galite būti siunčiamas kardiologo konsultacijai. Viršuje pateikta schema gali padėti Jūsų šeimos gydytojui nuspręsti kokių tyrimų Jums reikia.
Nepriklausomai nuo to, ar vaistas tik pradėtas vartoti ar vartojamas jau ilgą laiką, būtina laikytis vaisto vartojimo nurodymų. Neseniai atlikti tyrimai rodo, kad TKI grupės vaistai: imatinibas, nilotinibas ir dasatinibas neveikia efektyviai, jei per mėnesį bent kartą pamirštama laiku išgerti vaistus arba nesilaikoma hematologo nurodymų. TKI grupės vaistai veikia taip, kad nuolat slopintų baltųjų kraujo ląstelių susidarymą. Norint pasiekti gydymo tikslus labai svarbus tinkamas vaisto vartojimas.
Tam, kad pasiektumėte didįjį molekulinį atsaką (MA) – vieną iš pagrindinių gydymo tikslų – privalote atlikti 3 svarbius veiksmus:
1. Gerkite vaistus tiksliai taip, kaip paskyrė gydytojas. Kodėl tai svarbu?
Nuolatinis vaistų vartojimas yra vienintelis moksliškai įrodytas būdas pasiekti LML gydymo tikslus:
Net jei ir pasiekėte MA – vis tiek privalote reguliariai gerti vaistus tam, kad liga nepradėtų progresuoti.
Naujausi klinikiniai tyrimai rodo, kad geriamieji vaistai nuo LML neveikia taip gerai, kaip galėtų, jeigu bent kartą per mėnesį pamirštama išgerti vaistų dozę arba nesilaikoma kitų gydytojo hematologo nurodymų. Pamiršus pavartoti keletą dozių, atsakas į gydymą gali būti prastesnis, o tam tikrais atvejais gali pasireikšti atsparumas vaistui (tokiu atveju tektų keisti gydymo būdą).
2. Reguliariai atlikite molekulinius tyrimus. Kodėl tai svarbu?
Reguliarus RQ-PCR kraujo tyrimų atlikimas (molekulinis tyrimas iš periferinio kraujo mėginio) molekuliniame lygyje yra VIENINTELIS būdas nustatyti, ar pasiektas ir palaikomas molekulinis atsakas.
Mokslas sparčiai progresuoja, RQ-PCR tyrimas yra geriausias ir neskausmingiausias pacientui būdas, norint įvertinti ligą sukeliančio BCR-ABL kiekio kraujyje pokyčius, ypač, jei ligos aktyvumas Jūsų organizme yra mažas. Jei BCR-ABL organizme yra bent kiek aptinkama – tai gali sukelti ligos atsinaujinimą.
3. Stebėkite molekulinių tyrimų rezultatus. Kodėl tai svarbu?
Tai yra vienintelis būdas pasiekti gydymo tikslus – tik stebėdami tyrimo rezultatų kitimą matysite, kokia yra ligos eiga. Tai leis Jums ir Jūsų gydytojui priimti tolimesnius sprendimus ir sėkmingai slopinti ligą. RQ–PCR tyrimo rezultatų stebėjimo priemonė. Žinokite bent jau paskutinius savo molekulinių tyrimų rezultatus. Tai būtina siekiant reguliariai sekti ar BCR–ABL kiekis kraujyje mažėja ir Jūsų gydymo rezultatai gerėja. Toje pačioje laboratorijoje nustatyti didėjantys RQ–PCR rezultatai rodo, kad liga kontroliuojama nepakankamai.
Atsako į gydymą vertinimas
Pagal 2020 m. LML gydymo gaires numatomi šie gydymo tikslai:
Anksčiau buvo manoma, kad ligos gydymas turėtų būti tęsiamas visą paciento gyvenimą, tačiau dabar gydytojų bendruomenė sutaria, kad ligos gydymo tikslas yra pasiekti gilią remisiją ir ją palaikyti nutraukus vaistų vartojimą. Šis tikslas yra galutinis gydymo tikslas ir gali būti pasiekiamas ne visiems pacientams.
Labai svarbu, kad suprastumėte, jog Jūsų vartojamas vaistas padės pasiekti šių gydymo tikslų. Norint nustatyti, ar gydymas veiksmingas, yra vertinamas atsakas į gydymą. Jam nusakyti atliekami tam tikri tyrimai ir vartojamos tam tikros sąvokos:
Visiškas hematologinis atsakas reiškia, kad leukocitų, trombocitų ir raudonųjų kraujo ląstelių kiekis kraujyje tapo normalus, blužnis neapčiuopiama. Toks atsakas turi pasireikšti per pirmuosius tris gydymo mėnesius. Tyrimas kartojamas kas 2 savaites iki visiško hematologinio atsako, po to – kas 3 mėnesius.
Citogenetinis atsakas – ląstelių su Filadelfijos chromosoma sumažėjimas apie 100 kartų lyginant su šių ląstelių skaičiumi ligos diagnozavimo metu. Šį tikslą reikia pasiekti per 12 mėnesių ar anksčiau. Citogenetinis tyrimas kartojamas kartą per 3–6 mėnesius iki visiško citogenetinio atsako, po to – kartą per metus ar rečiau. Citogenetinis tyrimas atliekamas, kai remiantis molekulinių tyrimų rezultatais yra įtariamas nepakankamas gydymo efektyvumas arba ligos progresija.
Molekulinis atsakas – vėžį sukeliančio BCR–ABL geno sumažėjimas apie 1000 kartų nuo tada, kai liga buvo diagnozuota arba iki mažesnio kaip 0,1 proc. Šį tikslą reikia pasiekti per 18 mėnesių. Molekulinis tyrimas ligos kontrolei ir eigai vertinti atliekamas kas 3 mėnesius.
Ekspertai rekomenduoja kiekvieną tyrimą atlikti reguliariai (kas 3 mėnesius) toje pačioje laboratorijoje. Bendradarbiaukite su gydytoju hematologu, kad būtumėte tikri, jog viską darote teisingai.
Pasiekus gydymo tikslus Jūsų savijauta neabejotinai pagerės. Tačiau ir tuomet kasdien laikykitės visų gydytojo nurodymų, kad Ph+ LML ląstelių vėl nepadaugėtų. Pradėjus vartoti vaistus, labai svarbu juos vartoti reguliariai. LML gydymas yra nuolatinis ir nenutrūkstantis procesas. Net jei ir visi tyrimų rezultatai yra geri, tęsti gydymą būtina tam, kad liga ir toliau būtų sėkmingai slopinama, o Jūsų tyrimų rezultatai išliktų geri.
Kad galėtumėte stebėti savo ligos gydymo efektyvumą, turite žinoti savo RQ–PCR tyrimo rezultatus. Paklauskite gydytojo, kokia yra RQ–PCR procentinė dalis, kadangi žinant ją, ligos eigą stebėti lengviausia. Patikrinimų metu klauskite gydytojo Jums rūpimų dalykų, išsakykite savo abejones. Jei laikotarpiu tarp apsilankymų klausimus sunku atsiminti, juos užsirašykite. Jeigu sunku atsiminti, ką apsilankymo metu sako gydytojas, paprašykite, kad kartu su Jumis pas gydytoją atvyktų Jūsų draugas ar šeimos narys.
Gydymo nutraukimo kriterijai:
Kas yra RQ–PCR?
RQ–PCR tai tyrimas, kuriuo nustatomas BCR–ABL geno kiekis serume. Jis padeda tiksliai įvertinti leukeminių ląstelių kiekį ir aktyvumą.
Ar RQ–PCR tyrimas atliekamas naudojant kraujo ar kaulų čiulpų mėginius?
Tyrimą galima atlikti tiek iš kraujo, tiek iš kaulų čiulpų mėginių. Tačiau kadangi tyrimui yra svarbus pakankamas medžiagos kiekis, beveik visada pasirenkami kraujo mėginiai, kuriuos žymiai lengviau paimti.
Kaip dažnai atliekamas RQ–PCR tyrimas?
RQ–PCR tyrimas atliekamas kas 3 mėnesius.
Ar visada RQ–PCR tyrimo rezultatai turi būti vienodi?
Ne. Tyrimo rezultatams būdingi svyravimai ir jų pokyčiai neturėtų sukelti nerimo. Gydytojai atsargiai vertina rezultatus ir dažniausiai atsižvelgia į tyrimo rezultatų tendenciją (mažėjimą ar didėjimą). Dažniausiai naudojant tirozinkinazės inhibitorius ilgainiui tyrimo rezultatai mažėja. Visgi, rezultatų padidėjimas turėtų būti atidžiai įvertintas. Kreipiamas dėmesys į pokyčio dydį (ar jis minimalus, ar reikšmingas), taip pat atsižvelgiama į tai, iš kokio remisijos lygio stebimas rezultatų padidėjimas. Pokyčiai, nulemiantys didžiojo molekulinio atsako praradimą, turi būti atidžiai ištirti.
Kas gali nulemti rezultatų pokyčius?
RQ–PCR tyrimo rezultatai dažniausiai atspindi atsaką į gydymą. Jie gali įvairuoti dėl leukemijos ląstelių pokyčių, o taip pat dėl paties tyrimo metodikos. Kadangi šis tyrimas labai jautrus, tam pačiam pacientui skirtingose laboratorijose gali būti nustatyti skirtingi rezultatai. Todėl tyrimai turėtų būti atliekami toje pačioje laboratorijoje.
Neabejotinai tyrimų rezultatai taip pat priklauso nuo gydymo plano laikymosi. Pasikeitus RQ–PCR tyrimo rezultatams, pirmasis klausimas yra, ar pacientas tinkamai laikosi gydymo plano ir, ar gydymas nebuvo nutrauktas.
Pacientai, kurie yra vaisingo amžiaus ir ketina susilaukti vaikų gali susidurti su vaisingumo klausimais. Dažniausiai pacientams kyla klausimas, ar jie galės ateityje turėti vaikų, ar gydymas turės neigiamos įtakos vaisingumui ir nėštumui. Visais atvejais rekomenduojama dėl vaisingumo kilusius klausimus drąsiai užduoti gydančiam gydytojui, nes tik jis gali tiksliai įvertinti situaciją ir pateikti rekomendacijas dėl planuojamo šeimos pagausėjimo.
Pacientai, sergantys LML, prieš pradedant gydymą tirozinkinazės inhibitoriais (TKI) turėtų aptarti vaisingumo išsaugojimo klausimą su gydytoju. Dėl pažangaus gydymo vis daugiau pacientų pasiekia stabilią remisiją ir siekia susilaukti vaikų vartojant vaistus. Toliau pateikiame dažniausiai vyrams ir moterims kylančias problemas, susijusias su vaisingumu.
Vyrai. Atlikti moksliniai tyrimai įrodė, kad kai kurie vyrai, besigydantys TKI, turi mažesnį spermatozoidų kiekį ir sumažėjusį spermatozoidų judrumą. Vyrams, kurie gydosi TKI, prieš planuojant susilaukti vaiko rekomenduojama atlikti vaisingumo ištyrimą. Prieš gydymą, derėtų apsvarstyti spermatozoidų užšaldymo galimybę, siekiant išsaugoti sveikus spermatozoidus apvaisinimo procedūrai ateityje. Priklausomai nuo vartojamų vaistų ir paciento būklės stabilumo, gydytojas hematologas gali rekomenduoti nutraukti vaistus prieš 3–4 savaites iki planuojamo apvaisinimo. Šių dienų tyrimai nurodo, kad TKI vartojimas nekelia didelės rizikos vyrų vaisingumui.
Moterys. Moterims, kurios planuoja nėštumą sergant LML kyla daugiau įvairių problemų. Atliekama daugybė mokslinių tyrimų, siekiant nustatyti nėštumo riziką ir galimybes sergant LML ir besigydant tirozinkinazės inhibitoriais (TKI). Žinoma, kad imatinibas, dasatinibas ir nilotinibas pasižymi kenksmingu poveikiu embrionui ir vaisiui. Dėl šios priežasties yra registruota keletas vėlyvojo persileidimo ir apsigimimų atvejų. Planuojant nėštumą moterys, besigydančios LML turėtų išsamiai pasikonsultuoti su gydytoju hematologu bei vaisingumo specialistu dėl galimybės nutraukti gydymą TKI ir aptarti gresiančias rizikas vaisiui.
Vienas iš variantų yra nutraukti gydymą TKI vaistais nėštumo metu. Gydytojas tokią galimybę paliks tik tokiu atveju, jeigu pasiektas idealus atsakas į gydymą (mažiausiai – didysis molekulinis atsakas). Šiuo atveju pacientei bus rekomenduota nutraukti gydymą TKI mažiausiai prieš 4 savaites iki planuojamo nėštumo ir viso nėštumo metu. Gydymas bus atnaujintas iš karto po gimdymo, o maitinimas krūtimi – pakeistas alternatyviais maitinimo būdais. Nėštumo metu privaloma atidžiai stebėti kraujo molekulinių tyrimų rezultatus, siekiant kuo anksčiau nustatyti leukemijos progresavimą. Bet kokiu atveju, gydymo nutraukimas ir planuojamas nėštumas turi būti atidžiai prižiūrimas gydytojo hematologo ir vaisingumo specialisto viso nėštumo metu. Šiuo metu nėra duomenų apie tai, kad TKI gali būti saugiai vartojami nėštumo metu.
© 2017 Asociacija „Kraujas“. Visos teisės saugomos.
Sprendimas: Morka Labs